- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
獨立醫療器械軟件注冊產品性能指標中“訪問控制”有什么要求? 越來越多的獨立醫療器械軟件注冊產品應用于臨床,相比常規醫療器械注冊產品,醫療器械軟件注冊產品無論時形態、預期用途的實現、產品生產過程都有很大的區別。本文為大家說說獨立軟件產品性能指標中“訪問控制”的要求,一起看正文。 時間:2025-1-24 21:05:39 瀏覽量:442

-
冷凍消融儀產品技術要求及醫療器械注冊審查要點 冷凍消融儀由主機、同軸流體連接管(CFCT18)和冷凍消融 儀連接電纜(CC22RR)組成,產品與本公司生產的球囊型冷凍消融導管 (CS10510323、CS10510328)配合使用,用于成人患者藥物 難治性、復發性、癥狀性的陣發性房顫的治療。本文為大家介紹冷凍消融儀產品技術要求及醫療器械注冊審查要點,一起看正文。 時間:2025-1-23 22:49:24 瀏覽量:540

-
國家藥監局關于簡化港澳已上市傳統口服中成藥內地上市注冊審批的公告(2025年第7號) 2025年1月21日,國家藥監局發布《關于簡化港澳已上市傳統口服中成藥內地上市注冊審批的公告(2025年第7號)》,中醫中藥是老祖先留下來的珍貴瑰寶,期待中醫振興。 時間:2025-1-22 0:00:00 瀏覽量:792
-
2025年1月浙江省第二類醫療器械注冊審評情況 2025年1月22日,浙江省藥品監督管理局披露了2025年1月浙江省第二類醫療器械注冊審評情況,我們一起來看一下2025年首個月的實際審評情況數據,一起看正文。 時間:2025-1-22 22:37:27 瀏覽量:618
-
蛋白腦脊液定標液、蛋白腦脊液質控品等6個產品醫療器械優先審批申請獲批 2025年1月21日,國家藥監局發布《醫療器械優先審批申請審核結果公示(2025年第1號)》,總Tau蛋白腦脊液質控品、磷酸化tau-181蛋白腦脊液質控品、β淀粉樣蛋白1-42(Aβ1-42)腦脊液質控品、β淀粉樣蛋白1-42(Aβ1-42)腦脊液定標液、磷酸化tau-181蛋白腦脊液定標液,共計6個產品因屬于臨床急需,且在我國尚無同品種產品獲準注冊的醫療器械,醫療器械優先審評申請獲批。 時間:2025-1-21 22:42:44 瀏覽量:659

-
青光眼引流器、連續無針給藥系統等九個創新醫療器械特別審查申請獲批 2025年1月21日,國家藥監局發布《創新醫療器械特別審查申請審查結果公示(2025年第1號)》,青光眼引流器、連續無針給藥系統、顱內取栓支架 、可降解卵圓孔未閉封堵器等九個創新醫療器械特別審查申請獲批,一起來看具體內容。 時間:2025-1-21 22:33:13 瀏覽量:704

-
近視控制、弱視治療類醫療器械產品分類界定指導原則(征求意見稿) ?2025年1月20日,為指導近視控制、弱視治療類醫療器械產品的管理屬性和管理類別判定,國家藥監局組織起草了《近視控制、弱視治療類醫療器械產品分類界定指導原則(征求意見稿)》,并面向社會公開征求意見。一起來看具體內容。 時間:2025-1-20 22:06:12 瀏覽量:790
-
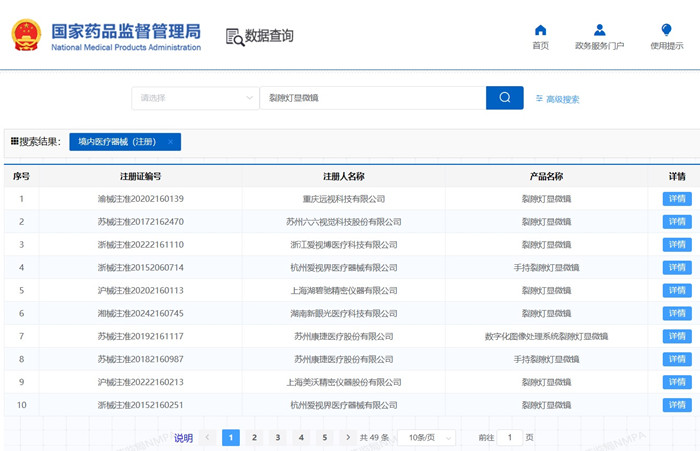
裂隙燈顯微鏡產品技術要求及醫療器械注冊審查要點 ?供檢查眼前節及眼內部病變用的裂隙燈顯微鏡在我國屬于第二類醫療器械注冊產品,裂隙燈顯微鏡通常由雙目立體顯徽鏡、變倍機構、裂隙照明機構、裂隙調節機構、顎托架裝置、固視燈、運動底座、電源裝置組成。本文為大家介紹裂隙燈顯微鏡產品技術要求及醫療器械注冊審查要點,一起看正文。 時間:2025-1-19 22:07:36 瀏覽量:510
-
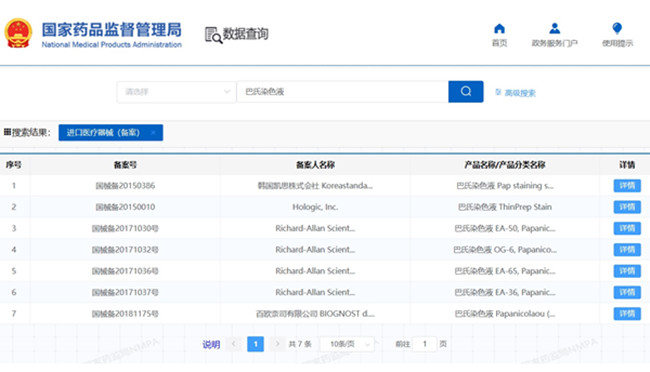
2024年12月進口第一類醫療器械產品備案信息 近日,國家藥監局披露《2024年12月進口第一類醫療器械產品備案信息》,2024年12月,國家局批準待測物清洗液、CMV探針試劑(原位雜交法)、骨刮匙、顯微鑷、骨科手術器械、巴氏染色液、助行器等進口第一類醫療器械產品備案167項,一起看正文。 時間:2025-1-18 0:00:00 瀏覽量:422
-
《醫療器械生產質量管理規范》修改前后對照表 《醫療器械生產質量管理規范》修改前后對照表 時間:2025-1-18 19:01:03 瀏覽量:940

-
2024年12月浙江省第二類醫療器械注冊審評情況 來自浙江省藥品監督管理局醫療器械技術審評公開的數據,2024年12月,浙江省累計有242項第二類醫療器械注冊產品轉入審評程序,轉出審結項目368項,一起來關注更多內容。 時間:2025-1-15 19:32:31 瀏覽量:414

-
國家局今日發布《醫療器械生產質量管理規范(修訂草案征求意見稿)》 2025年1月15日,為進一步加強醫療器械監督管理,持續規范醫療器械生產行為,提升企業質量管理合規能力和水平,根據《醫療器械監督管理條例》《醫療器械生產監督管理辦法》,國家藥監局組織起草了《醫療器械生產質量管理規范(修訂草案征求意見稿)》,并向社會公開征求意見。 時間:2025-1-15 19:22:31 瀏覽量:425

-
有源醫療器械注冊產品使用期限變更為,可以走說明書變更嗎? 對于已取得醫療器械注冊證的有源醫療器械產品,如果醫療器械注冊人希望調整產品的有效期,比如希望將有源醫療器械使用期限5年變更為10年,可以走說明書變更嗎?一起看正文。 時間:2025-1-14 0:00:00 瀏覽量:355
-
可見光譜治療儀產品技術要求及醫療器械注冊審查要點 光是最常見的能量形式之一,各種各樣的光在醫療行業廣泛醫用,常見的X光、激光、強脈沖光,紅外光、藍光等等,今天給大家介紹可見光譜治療儀產品技術要求及醫療器械注冊審查要點,說說波長范圍在400nm—780nm的非激光光源對人體體表和/或自然腔道進行輻照治療的可見光譜治療儀。 時間:2025-1-13 0:00:00 瀏覽量:482

-
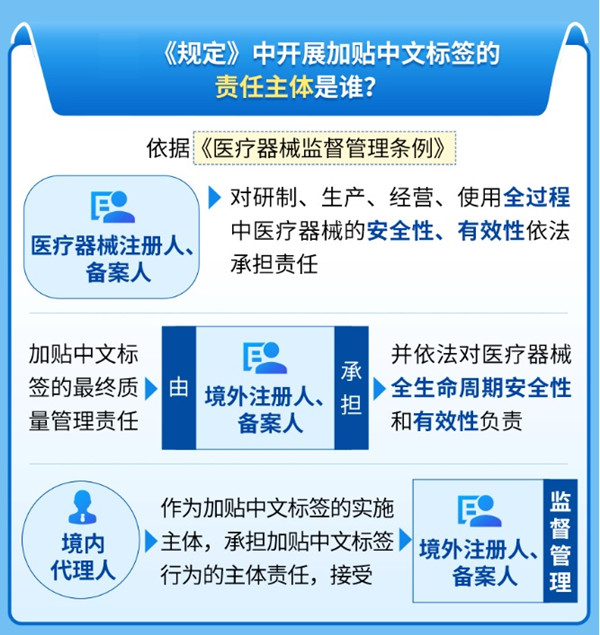
中國(上海)自由貿易試驗區進口醫療器械加貼中文標簽規定(試行) 為貫徹落實國務院和上海市政府關于高水平制度型開放的方案要求,充分發揮中國(上海)自貿試驗區(含臨港新片區,以下簡稱上海自貿試驗區)先行先試作用,規范進口醫療器械加貼中文標簽的行為,根據《醫療器械監督管理條例》、《醫療器械說明書和標簽管理規定》以及其他國家有關要求,制定《中國(上海)自由貿易試驗區進口醫療器械加貼中文標簽規定(試行)》。 時間:2025-1-13 0:00:00 瀏覽量:478
-
《關于全面深化藥品醫療器械監管改革促進醫藥產業高質量發展的意見》政策解讀 ?為深入貫徹落實習近平總書記關于藥品醫療器械監管和醫藥產業發展的重要指示批示精神,全面深化藥品醫療器械監管改革,促進醫藥產業高質量發展,經國務院同意,近日國務院辦公廳印發《關于全面深化藥品醫療器械監管改革促進醫藥產業高質量發展的意見》(以下簡稱《意見》)。現就有關內容予以解讀。 時間:2025-1-12 21:04:18 瀏覽量:345
-
浙江省第一類醫療器械備案證超1萬張(截至2024年12月31日) 來自國家藥監局2025年1月10日披露的數據,截止2024年12月31日,浙江省第一類醫療器械備案證數量達到10407;江蘇省第一類醫療器械備案證數量達到34127張,上海市第一類醫療器械備案證數量是8323張,更多數據如下表所示: 時間:2025-1-11 22:39:23 瀏覽量:438

-
國家藥監局2024年12月批準進口醫療器械注冊產品47個 2025年1月10日,國家藥監局發布《關于批準注冊259個醫療器械產品的公告(2024年12月)(2025年第4號)》。 2024年12月,國家藥監局共批準注冊醫療器械產品259個。其中,進口第三類醫療器械產品23個,進口第二類醫療器械產品22個,港澳臺醫療器械產品2個。一起來看具體哪些進口醫療器械注冊產品獲批。 時間:2025-1-10 0:00:00 瀏覽量:468
-
國家藥監局2024年12月批準212個境內第三類醫療器械注冊產品 2025年1月10日,國家藥監局發布《關于批準注冊259個醫療器械產品的公告(2024年12月)(2025年第4號)》,其中,2024年12月,國家藥監局共批準注冊醫療器械產品259個,其中境內第三類醫療器械產品212個。一起來看具體是哪些產品獲批。 時間:2025-1-10 0:00:00 瀏覽量:504
-
2025版《醫療器械監督管理條例》 主要變化及重點項導讀 2025年1月7日國家藥品監督管理局發布了《醫療器械監督管理條例》,此次為根據2024年12月6日《國務院關于修改和廢止部分行政法規的決定》的第二次修訂版。一起來學習了解2025版《醫療器械監督管理條例?》 主要變化及重點項導讀。 時間:2025-1-9 20:09:16 瀏覽量:3388

