- 醫療器械注冊
- 第二類醫療器械注冊 第三類醫療器械注冊 進口醫療器械注冊 第一類醫療器械備案 體外診斷試劑注冊 醫療器械產品技術要求 醫療器械生產許可證
- 醫療器械CE認證
- 醫療器械CE認證 FDA注冊(備案) 醫療器械境外注冊服務 ISO13485認證 ISO15378醫療包材體系認證 MDSAP認證服務 ISO13485內審員培訓
- 醫療器械臨床試驗
- 醫療器械臨床試驗服務 同品種比對臨床評價 體外診斷試劑(IVD)臨床試驗服務 臨床協調員(CRC)服務 進口醫療器械補充臨床試驗服務 醫院臨床試驗機構備案服務 醫療器械主文檔登記
- 醫療器械經營許可
- 醫療器械經營許可證辦理 第二類醫療器械經營備案 醫療器械網絡銷售備案 醫療器械分類界定代辦 醫療器械飛行檢查服務 醫療器械注冊檢驗資質 醫療器械創新申報代辦
- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
手動洗鼻器,又稱為洗鼻器、鼻部沖洗器等名稱,產品通常由沖吸管、管路和連接口組成。采用金屬材料制成。不含沖洗液。非無菌提供,可重復使用。使用前由使用機構根據說明書進行滅菌或消毒(如適用)。不在內窺鏡下使用。洗鼻器用于手術中沖洗組織或吸液。依據《第一類醫療器械產品目錄(2021年第158號)》,產品屬于第一類醫療器械,本文為大家說說手動洗鼻器產品技術要求及第一類醫療器械備案要點。
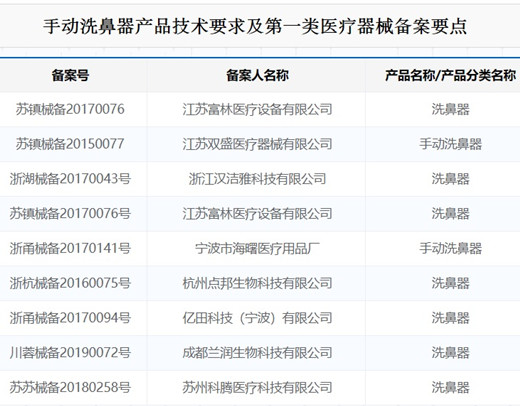
一、手動洗鼻器產品技術要求
醫療器械產品技術要求編號:/
洗鼻器
1.產品型號/規格及其劃分說明:
1.1 產品組成
由洗鼻頭、藥腔蓋、內芯、藥腔、按壓開關和連接管插孔組成。使用前裝入沖洗液,與相關的沖洗 設備或器具連接成沖洗系統,可向患者鼻部進行沖洗。非無菌提供(如在無菌環境下使用,使用前應經 滅菌處理)。
1.2 規格型號 規格型號:ZBK-8901N01、ZBK-8901N02、ZBK-8901N03、ZBK-8901N04
1.3型號規格及其劃分說明
ZBK是杭州證標客醫藥技術咨詢有限公司簡稱。
2 性能指標
2.1 外觀
2.1.1 沖洗器外形應整齊,不允許有毛刺、凹凸不平和刮痕;
2.1.2 外觀色澤應均勻,整潔,表面文字、標記應清晰、準確,標簽應粘貼牢固。
2.2 尺寸
2.2.1 規格尺寸,按產品型號規定的尺寸對產品進行測量。
2.3 無泄漏 在正常工作時不應漏液;
2.4 輸出量 ≥0.5ml/min
2.5 裝藥量 最大裝液量應為標稱的裝量±2mL
2.6 化學性能
2.6.1 重金屬 檢驗液所呈現的顏色不得超過質量濃度ρ(Pb2+)=1μɡ/mL的標準對照液。
2.6.2 酸堿度 浸出液與同批空白對照液相比,pH值之差應不超過1.5。
2.6.3 還原物質 浸出液和空白液消耗高錳酸鉀溶液[c(1/5KMnO4)=0.01mol/L]的體積之差不超過2.0mL。
3.檢驗方法
略。
二、第一類醫療器械備案要點
完成的第一類醫療器械備案事項包括第一類醫療器械產品備案證辦理、第一類醫療器械生產備案憑證辦理,以及建立醫療器械生產質量管理體系。盡管第一類醫療器械屬于備案事項,但是市場監督管理局越來越頻繁的覆蓋第一類醫療器械生產企業的檢查。所以,請大家記得申請第一類醫療器械備案時,一定要做好醫療器械生產質量管理體系哦。
如有手動洗鼻器產品技術要求編制或是第一類醫療器械備案代辦服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。
【可辦地區】浙江、上海、江蘇、安徽、北京、天津、重慶、福建、廣東、廣西、貴州、甘肅、河南、黑龍江、湖北、湖南、河北、江西、吉林、遼寧、寧夏、內蒙古、青海、山東、山西、陜西、四川、云南。
下一篇:耳鏡產品技術要求及第一類醫療器械備案要求
