供醫療機構用于對瞼板腺功能障礙的成人干眼患者進行眼瞼局部 加熱和按壓治療的液脈動干眼治療儀,在我國屬于第二類醫療器械注冊產品,液脈動干眼治療儀通常由主機和一次性使用治療頭及軟件組成,本文為大家介紹液脈動干眼治療儀產品技術要求及醫療器械注冊要點,一起看正文。
供醫療機構用于對瞼板腺功能障礙的成人干眼患者進行眼瞼局部
加熱和按壓治療的液脈動干眼治療儀,在我國屬于第二類醫療器械注冊產品,液脈動干眼治療儀通常由主機和一次性使用治療頭及軟件組成,本文為大家介紹液脈動干眼治療儀產品技術要求及醫療器械注冊要點,一起看正文。
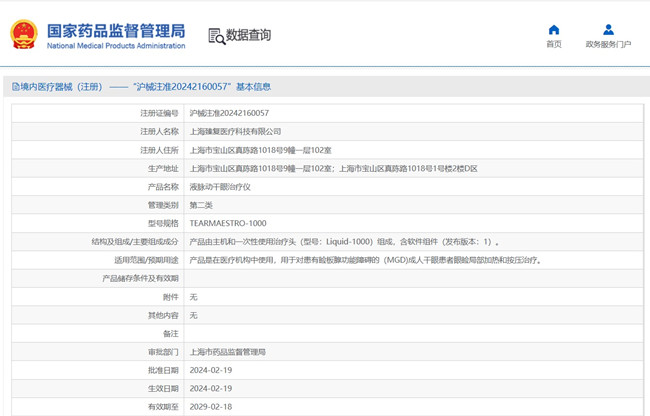
一、液脈動干眼治療儀注冊產品的工作原理
液脈動干眼治療儀主機連接到一次性使用治療頭,使用時嵌入患者的眼瞼。液脈動干眼治療儀為眼瞼內表面的瞼板腺附近提供受控的熱量,并在眼瞼外表面施加間歇性的壓力,促進囊性瞼板腺流出脂質。
二、液脈動干眼治療儀產品技術要求
液脈動干眼治療儀產品技術要求包括主機部分要求和治療頭部分性能指標要求,具體如下:
(一)液脈動干眼治療儀性能指標要求:
包括:外觀、安全工作溫度以及溫度誤差范圍、超溫控制、壓強范圍、壓強波形、超壓保護、噪聲、治療時間、軟件功能。
(二)一次性使用治療頭性能指標要求:
包括:物理性能、密封性能、連接牢固度、化學性能、無菌以及環氧乙烷殘留。
三、液脈動干眼治療儀注冊審查要點
(一)生物相容性
液脈動干眼治療儀注冊產品與眼睛接觸,申請人按照GB/T16886系列標準對所有部件分別進行了生物相容性評價,產品的生物相容性風險應可接受。
(二)環氧乙烷滅菌工藝驗證
液脈動干眼治療儀注冊產品部件一次性使用治療頭以無菌狀態提供,采用環氧乙烷滅菌,申請人提供了滅菌確認報告,證明無菌保證水平為10
-6,提供環氧
乙烷殘留量要求以及相關研究資料。
(三)產品有效期和包裝研究
一次性使用治療頭貨架有效期為18個月。申請人提供了貨架有效期驗證報告,封口工藝驗證報告等。主機的使用期限為5年,對部 進行詳細分析并確定產品壽命評價方法。同時提供產品包裝完整性和模擬運輸驗證。
如有液脈動干眼治療儀產品技術要求編制服務或是醫療器械注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。