本文來自《中國器審》����,我特別認同文中作者觀點——以臨床價值為導向開展醫療器械研制�,臨床應用價值應是醫療器械研制的起點,亦是醫療器械研制的終點�,從臨床應用開始�,最后回歸到臨床應用��。對于我國醫療器械行業來說�,這幾年逐步由仿制到自研的過渡�,越來越多器械創新工作者,器械創新企業走在創新�、創業、創造這條路上,因此,轉載此文章供大家閱讀�,并作為商業用途����。
引言:本文來自《中國器審》�,我特別認同文中作者觀點——以臨床價值為導向開展醫療器械研制,臨床應用價值應是醫療器械研制的起點,亦是醫療器械研制的終點���,從臨床應用開始,最后回歸到臨床應用。對于我國醫療器械行業來說�,這幾年逐步由仿制到自研的過渡��,越來越多器械創新工作者,器械創新企業走在創新����、創業�����、創造這條路上,因此����,轉載此文章供大家閱讀����,并作為商業用途����。
引言
金屬骨針作為骨科手術中的關鍵植入器械之一,廣泛應用于骨折固定、畸形矯正及關節融合等領域���。近年來,隨著材料科學和制造技術的進步,產業涌現出越來越多全新設計產品,金屬骨針的設計逐漸從單一功能向精準化、個性化方向發展。為更好地保證產品臨床使用的安全有效性����,這類產品的上市前非臨床研究尤顯重要。本文從臨床價值導向出發�,探討金屬骨針產品的設計開發���、風險管理及技術審評的關鍵點����。
一����、以臨床價值為導向設計金屬骨針產品的必要性
1.臨床需求的驅動
骨科醫療器械市場雖然技術迭代迅速,但臨床效果并未同步提升。研究表明,約20%的骨科植入物因設計不合理導致術后并發癥,如假體松動、感染和力學失效等[1]�,而傳統醫療器械的設計存在過度關注技術參數而忽視臨床實際��,導致部分植入物與患者解剖結構匹配度不足,術后并發癥發生率居高不下。有文獻顯示����,傳統骨針在骨質疏松患者中易發生松動或斷裂�,導致二次手術率高達15%[2]。這種脫節現象凸顯了以臨床價值為導向的設計必要性。臨床價值導向要求設計需直接回應未被滿足的需求�����,如縮短手術時間���、降低感染風險等��。
2.政策法規的推動
各國監管機構正逐步加強對醫療器械臨床價值的重視���。例如�����,我國國家藥品監督管理局在發布的《醫療器械臨床評價技術指導原則》[3]中強調真實世界數據的重要性。美國FDA在2017年發布的《突破性醫療器械計劃》[4]也明確要求以臨床終末效益為核心評價指標。醫療器械服務于臨床實踐,高水平的設計開發才能更好地實現產品的高質量發展���,從而滿足人民日益增長的美好健康需要�。
3.醫療經濟學的考量
以臨床價值為導向的設計不僅能提高治療效果,還能降低醫療成本����。研究表明�����,通過優化醫療器械產品設計可減少術后并發癥,可使單例患者的綜合治療成本降低30%[5]�����。
4.患者個體化差異的考量
骨科醫療器械設計需從解剖��、生物力學和手術操作三個維度解構臨床需求���,不同解剖部位(如股骨與指骨)對骨針的力學性能要求差異顯著���。因此����,醫療器械的設計需基于大數據分析或影像學建模�����,實現解剖適配性���。
二��、金屬骨針類產品設計開發的關注點
金屬骨針類產品作為骨科比較成熟的醫療器械產品之一���,其生產研發歷史相對較長�����。此類器械的設計開發需緊密圍繞骨針類產品在臨床的預期適用范圍�,如四肢骨折復位時部分植入人體做牽引�����、配合外固定支架進行四肢骨折固定或單獨植入等���,因此����,金屬骨針的設計開發需重點關注以下幾點:
1.材料選擇與性能優化
材料類型:如316L不銹鋼(成本相對低)���、鈦合金(生物相容性較優)��、鈷鉻合金(耐磨性較強)的取舍需權衡力學性能與生物學響應[6]����。
表面改性:如羥基磷灰石(HA)涂層可提升骨整合,但需控制結晶度(60%-70%)以避免剝落風險[7]����。
2.結構設計與制造工藝
幾何參數:如螺紋深度�、螺距需匹配骨密度分布���。有限元分析(FEA)顯示���,錐形設計可減少應力集中達40%[8]���。
制造技術:如增材制造(如SLM)支持復雜結構�,但需驗證內部缺陷率(應<0.1%)[9]��。
3.生物相容性與力學驗證
參照GB/T 16886.1進行生物學評價�����,必要時開展相應生物學試驗,如細胞毒性、致敏性及植入后局部反應��。
力學測試:可參考相應標準要求���,對骨針開展動靜態力學性能測試���,詳見表1�����。
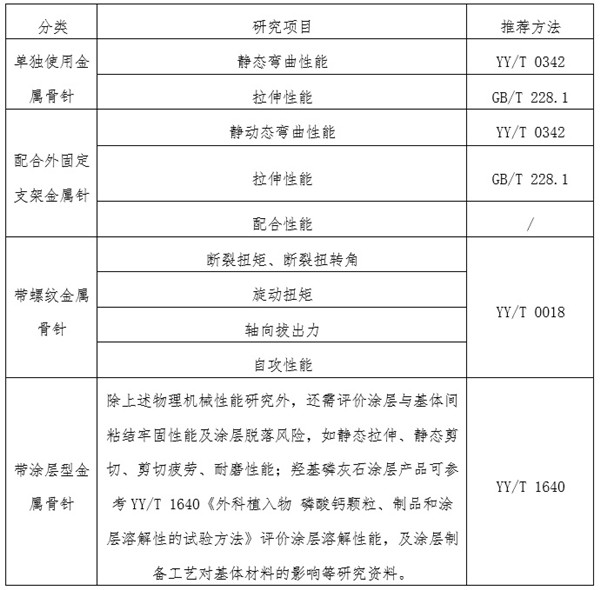
三��、金屬骨針類產品技術審評的關注點
為指導注冊申請人對金屬骨針注冊申報資料的準備及撰寫,同時也為技術審評部門對金屬骨針類產品注冊申報資料的審評提供參考,我們在現行法規和標準體系以及當前認知水平下總結了此類產品在技術審評時需關注以下內容:
1.非臨床研究部分
產品風險管理資料
醫療器械安全和性能基本原則清單
產品技術要求與性能指標,如抗拉強度���、斷裂伸長率、不銹鋼產品的耐腐蝕性能、表面缺陷�����、表面粗糙度����,外觀����、關鍵尺寸及公差 、無菌��、環氧乙烷殘留量�;對于帶涂層骨針,還需明確涂層表面粗糙度�、涂層與基體粘接強度��。
研究資料:產品物理性能研究(見表1),化學/材料表征研究�、生物學特性研究��、穩定性研究。
表1金屬骨針物理和機械性能研究及推薦方法
2.臨床評價部分
對于已納入《免于臨床評價醫療器械目錄》的傳統金屬骨針需按照《列入免于進行臨床評價醫療器械目錄產品對比說明技術指導原則》開展評價�����,但對于目錄外金屬骨針產品還需開展更為詳細的臨床評價����,如增加超出范圍產品的臨床評價資料,同時建議重視真實世界證據�,盡可能多的收集相應真實世界的臨床使用數據[10]��,重視不良反應事件報告。
結語
綜上���,如何實現以臨床價值為導向的金屬骨針產品設計開發,首先要求從事醫療器械生產����、設計開發的企業需要非常熟悉國家現行的醫療器械生產���、經營�����、注冊等相關法律法規及指導文件,認真學習各類文件����,正確運用指導文件���,關注金屬骨針類產品在臨床使用中的痛點����,堅持以臨床價值為核心��,重視風險管理��,嚴格落實產品質量可靠,體系穩定的要求��,進一步完善上市后的追蹤反饋����。未來,隨著精準醫療與智能制造的融合�,相信會有更多以臨床需求為價值導向的骨針產品上市��,進一步改善患者預后,這需要我們的審評體系同步革新以平衡創新與風險管理�。
如有醫療器械注冊咨詢服務需求�����,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:呂工�,電話:18058734169����,微信同����。