廣西藥監局發布《廣西壯族自治區藥品監督管理局關于施行第二類醫療器械首次注冊告知承諾審批的通知》,10月10日起,廣西行政區域范圍內企業在申報階段可以不提交醫療器械注冊檢驗報告!自此,企業承諾能代替某項申報資料了。
引言:廣西藥監局發布《廣西壯族自治區藥品監督管理局關于施行第二類醫療器械首次注冊告知承諾審批的通知》,10月10日起,廣西行政區域范圍內企業在申報階段可以不提交醫療器械注冊檢驗報告!自此,企業承諾能代替某項申報資料了。

根據《自治區黨委辦公廳、自治區人民政府辦公廳關于印發〈廣西深化審評審批制度改革鼓勵藥品醫療器械創新實施方案〉的通知》以及《廣西壯族自治區人民政府辦公廳關于印發進一步推進政務服務“簡易辦”實施方案的通知》的相關要求,自治區藥品監管局深入推進廣西第二類醫療器械首次注冊審批制度改革,決定10月10日在全范圍內對第二類醫療器械(包含體外診斷試劑)(以下簡稱第二類醫療器械)首次注冊實行告知承諾審批。此舉對于廣西承接大灣區醫療產業戰略轉移、提高廣西醫療器械產業發展水平和競爭力具有重要意義。
一、承諾審批主要有以下五個基本原則:
1.寬準入、嚴監管、強服務。圍繞“減少審批材料、提高審批效能、服務企業發展”的總體思路,探索建立“誠信規范、審批高效、監管完善”的告知承諾審批新模式,引導第二類醫療器械產品注冊管理向“寬準入、嚴監管、強服務”轉變,推動我區醫療器械行業高質量發展。
2.簡化審批流程。企業根據告知書相關內容作出符合第二類醫療器械首次注冊(告知承諾審批)適用條件的承諾,自治區藥監局依據企業承諾,同意企業在醫療器械生產許可環節補交相應材料,提高審批效率,提升服務效能。
3.繼續提速加快注冊檢驗審評審批。《醫療器械監督管理條例》(2017年國務院令第680號)明確規定第二類醫療器械注冊審批法定時限23個工作日,技術審評法定時限60個工作日。自治區藥監局擬對醫療器械首次注冊辦理時限在法定辦理壓縮60%的基礎上再進一步提速,即審批辦理時限壓縮至9個工作日、技術審評時限壓縮至24個工作日,以最快的速度、最優的質量,解決好申報企業的注冊檢測和技術審評時限問題。
4.加強事后監管。在企業申請醫療器械生產許可之時,行政審批機關按照法定條件和標準要求,組織對其進行合格注冊檢驗報告及檢驗機構出具的產品技術要求預評價意見等材料進行技術審評,并開展注冊質量管理體系及生產質量管理規范的合并現場檢查。經技術審查和現場檢查,發現存在實際情況與承諾內容不符的,行政審批機關將依法撤銷以告知承諾審批方式獲批的第二類醫療器械注冊證并向社會公告,同時載入該企業的信用檔案。此后,該企業不再適用于告知承諾申辦方式。
5.加強信用管理。根據《廣西壯族自治區食品藥品安全信用分級分類管理辦法(試行)》(桂食藥監綜〔2016〕3號)等有關規定進行信用評價,記入信用檔案,進行信息共享。
在監督管理方面,審批事中事后監管中如發現申報企業承諾內容與實際情況不相符的,自治區藥監局將依法撤銷其醫療器械注冊證并向社會公告,同時載入該企業的信用檔案。此后,該企業不再適用于告知承諾審批方式。
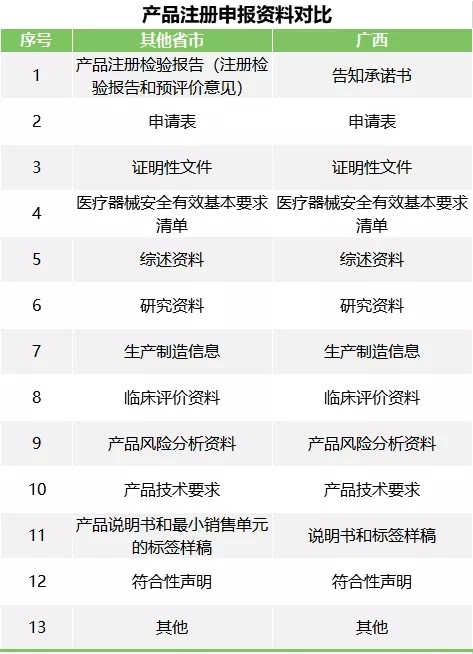
二、新規實施后,廣西與其它省市二類醫療器械注冊申報資料對比:
下圖是廣西與其它區域二類醫療器械注冊申報資料對比,注冊申報時,廣西可以不提交醫療器械注冊檢驗報告,這將大幅縮短注冊總時間。
附件:《廣西關于試行第二類醫療器械首次注冊告知承諾審批的通知》下載:
 廣西關于試行第二類醫療器械首次注冊告知承諾審批的通知.pdf
廣西關于試行第二類醫療器械首次注冊告知承諾審批的通知.pdf