血液融化設備通常包括血液融化箱��、血漿融化箱����、冰凍血漿解凍箱�、冷凍血漿干式解凍儀,用于對臨床血漿或血液進行加熱、解凍��,廣泛應用與臨床一線�����。本文為大家科普血液融化設備注冊要求及審查要點,方便醫療器械注冊企業更好規劃產品研制及注冊申報工作����。
血液融化設備通常包括血液融化箱�����、血漿融化箱、冰凍血漿解凍箱���、冷凍血漿干式解凍儀,用于對臨床血漿或血液進行加熱�、解凍���,廣泛應用與臨床一線�。本文為大家科普血液融化設備注冊要求及審查要點��,方便醫療器械注冊企業更好規劃產品研制及注冊申報工作���。
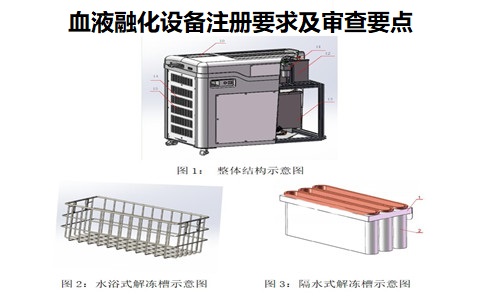
1.血液融化設備組成結構與預期用途:
血液融化設備通常由加熱水箱���、解凍槽����、循環管路�、進水管、排水管��、控制箱等組成�����。分為水浴式�����、隔水式。用于對臨床血漿或血液進行加熱����、解凍��。
根據解凍水箱中解凍槽(解凍夾、解凍籃)的不同可以分為水浴式和隔水式����。水浴式結構解凍過程中解凍血袋與熱水直接接觸�,隔水式結構解凍過程中解凍血袋與熱水進行隔離�����,兩者不直接接觸�。
不同生產企業的產品���,在結構上存在一定差異���,可以與本部分描述不完全一致��,組成部分的名稱也不限于文中描述�����。
2. 血液融化設備產品技術要求的主要性能指標
產品技術要求應按照《醫療器械產品技術要求編寫指導原則》的規定編制。解凍溫度主要參考《血站技術操作規程(2019版)》和《臨床輸血技術規范》制定�����。如《血站技術操作規程(2019版)》要求��,冰凍紅細胞存儲溫度:≤-120℃(20%甘油),≤-65℃(40%甘油);解凍為:37~40℃恒溫水浴融化?��!杜R床輸血技術規范》要求,冰凍血漿存儲溫度:≤-20℃;解凍為:37℃水浴融化���。冷沉淀存儲溫度:≤-20℃;解凍方式參考冰凍血漿�。
2.1.產品型號規格及其劃分說明
產品可按結構組成����、技術參數��、預期用途等劃分為不同型號和規格�。
若有產品有多個型號�����,應提供型號間的主要差異對比表�。
若含有軟件��,應按照《醫療器械軟件注冊技術審查指導原則》的要求��,明確相應信息,如軟件的名稱、型號規格��、發布版本����、版本命名規則等。
2.2 解凍性能:
2.2.1 最大解凍容量:在申請人聲稱的擺放方式下,最大的血袋數量��。
2.2.2 升溫時間:預熱完成后��,加入最大數量冰凍血袋后����,溫度重新上升到設定解凍溫度的時間����,升溫時間應符合申請人的規定���。
2.2.3 解凍溫度:
冷凍血漿:37℃;
冰凍冷沉淀:37℃;
冰凍紅細胞:37~40℃���。
溫度的均勻性、波動范圍應符合申請人的規定。
2.3 水位監控功能:
應有水位監測裝置���,當水位低于申請人要求時,應停止加熱并發出異常提示。
2.4 顯示功能
水位�����、溫度等顯示范圍及誤差�����。
2.5 溫度保護功能:
應提供至少一個獨立的超溫保護裝置�����,該裝置應在不超過最高設定溫度+2℃動作,停止加熱,并提供連續的聽覺和視覺提示。
2.6 隔水功能(隔水式適用)
解凍過程中�����,解凍槽的隔水部件不應漏水���。
2.7 擺動功能(若適用)
擺動幅度��、擺動頻率應符合申請人的規定。
2.8 清洗消毒功能�。
若產品具有清洗或消毒功能��,應明確清洗流程,消毒方式��、消毒參數�。
2.9 噪聲
產品工作噪聲應≤65dB(A)。
2.10 軟件
明確軟件的功能���、訪問控制等要求,且應與說明書中的功能描述一致�����。
2.11網絡安全
數據接口和用戶訪問控制要求���。
明確軟件的功能�、訪問控制等要求,且應與說明書中的功能描述一致���。
2.12 安全性能
電氣安全應符合GB 4793.1、GB 4793.6的要求���。
電磁兼容應符合GB/T18268.1 的要求。
2.13 其他
產品具有的其他特定功能��,應制定相應的指標�����。如二維碼掃描功能等�。
3.醫療器械注冊單元劃分
應按照《醫療器械注冊與備案管理辦法》����、《醫療器械注冊單元劃分指導原則》要求,著重考慮產品的技術原理��、結構組成��、性能指標、適用范圍等因素進行綜合判定�����。