對于看美國市場的醫療器械企業來說,上市成本除了固定金額的企業注冊、產品列名、510K評審費之外,更大一筆支出是為了滿足美國FDA對醫療器械注冊產品檢測的要求,一起來看一下有哪些檢測要求。
引言:對于看美國市場的醫療器械企業來說,上市成本除了固定金額的企業注冊、產品列名、510K評審費之外,更大一筆支出是為了滿足美國FDA對醫療器械注冊產品檢測的要求,一起來看一下有哪些檢測要求。

眾所周知,FDA的510(K) 的原則是證明申報器械和已經在美國合法上市的器械是實質等同。如果能夠證明是實質等同,那么就可以確認其滿足FDA 510(K)的要求。
實質等同包括了很多方面的內容,包括產品的預期用途,工作原理,結構和配件,很重要的一點是包括其安全性和功能性。下面我們通過兩個產品來分析,一個是無源器械活檢針,一個是有源器械電動輪椅。
1.電動輪椅:
進行實質等同比對的項目包括:主體框架材料和設計,折疊機制,座椅設計,座椅附件,輪椅總體尺寸,座椅尺寸,折疊后尺寸,輪椅重量,電池重量,控制器,驅動模式,電機類別,電機功率,電池類型,電池數量,電池規格,充電模式,剎車類型,剎車距離,各部件材料。除了這些之外,還需要比對生物相容性、EMC、性能要求。分別涉及到如下的檢測標準,需要提供全套測試報告:

2.活檢針:
進行實質等同比對的項目包括:預期用途、尺寸規格、作用機理、可用性、動力類型。還包括系列測試:
(1)生物相容性和滅菌:
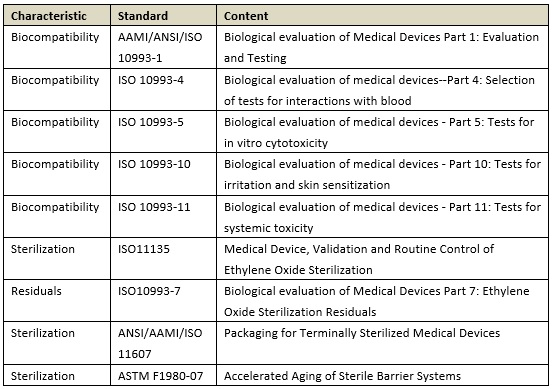
(2)性能測試和比對測試:
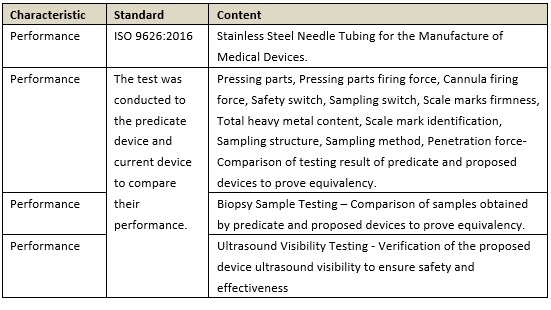
從上述兩個案例來看,要證明產品實質等同就必須要提供詳實的實驗數據予以支撐,才能得到有效的結論。
標簽:美國FDA醫療器械注冊